原标题:美欧疫情告急!中国超20家企业的快速检测产品集体“出海”,这背后的机与危
美欧疫情告急!中国超20家企业的快速检测产品集体“出海”,这背后的机与危《科创板日报》(上海,记者 徐红)讯,“这次新冠疫情对于国内(体外诊断,IVD)企业来说,是一次很好的国际化机会!”3月10日晚,一家新冠检测产品刚宣布获得欧盟准入资格的公司董事长如是在其朋友圈写道。
随着新冠疫情在欧、美等国蔓延,国产检测试剂产品也趁势加速“出海”。
据《科创板日报》记者不完全统计,截至目前,已经有约20家国内体外诊断企业宣布其新冠病毒检测产品获得欧盟准入资格或CE证书,进入国际新冠检测市场。这些企业包括华大基因(300676.SZ)、万孚生物(300482.SZ)、凯普生物(300639.SZ)、达安基因(002030.SZ)、美康生物(300439.SZ)、迈克生物(300463.SZ)、东方生物(688298.SH)、之江生物(834839.OC)、新健康成(831193.OC)、圣湘生物等。
然而,从国内的情况来看,截至目前,国家药监局批准上市的新冠病毒快速检测产品共计15个,包括10个核酸检测试剂和5个抗体检测试剂。
换言之,目前国内获批上市的新冠病毒快速检测产品还没有海外上市的多。也因此,不少“围观群众”纷纷吐槽,认为国外上市比国内上市还容易,“这怎么可能”?
不过,《科创板日报》记者采访多位业内人士和专家后了解到,目前国产新冠病毒快速检测产品选择了认证流程更加简单迅速的方法,以获得欧盟市场准入资格,这是基于现实情况的合理选择,但也因此,这些产品上市后的市场前景仍有待观察。
疫情:一次企业乘势出海的机会
体外诊断试剂是指采用免疫学、微生物学、分子生物学等原理或方法制备的,在体外用于对人类疾病的诊断、检测及流行病学调查等的诊断试剂。常见体外诊断试剂可以分为生化试剂、免疫试剂、分析试剂、POCT四类。
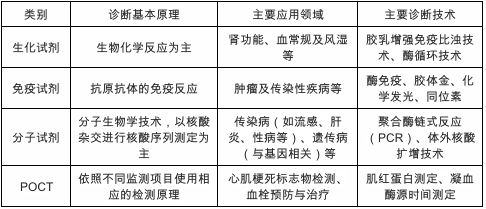
图| 体外诊断试剂分类;来源:中国产业信息网
我国体外诊断试剂行业起步于上世纪80年代初,与欧美国家相比较晚,产业化发展相对滞后。目前,国内体外诊断试剂生产企业多达上千家,但实力较强的综合性企业并不多,企业普遍规模小品种少。同时,国内体外诊断市场仍以处于第一梯队的跨国巨头为主导,并且高端市场基本也被海外巨头垄断。
不过,随着近几年我国体外诊断试剂行业从导入期步入发展期,市场需求快速增长,国内企业亦抓住机遇,凭借性价比更高的产品和更为贴近本土市场的优势,不断进行进口替代抢占市场份额,并在某些产品领域逐渐具备与国际巨头竞争的实力。
这一次突如其来的新冠疫情,可以说让IVD行业顿时成为全国人民关注的热点。
与致病性病原体抗原、抗体以及核酸等检测相关的体外诊断试剂在我国属于第三类体外诊断试剂(产品风险等级最高),原本需要2~3年才能完成注册上市(含临床试验),但在此次疫情中,通过应急审批通道,这个审批时限由两、三年变成了短短几天。
抗疫一线急需加上审评审批程序的简化,这也让众企业纷纷投入到这个市场。据不完全统计,仅在1月底,就有超过50家企业开发出了新冠病毒检测试剂盒。然而,这些产品不可能都能获批上市,加上疫情在国内逐步稳定检测需求慢慢下降,因此企业们也将眼光瞄准了海外。
《纽约时报》数据库显示,截至美东时间3月11日下午3时,在美国39个州和华盛顿特区,已有1032人的冠状病毒检测呈阳性反应,并且至少有31名新冠肺炎患者死亡。
而欧洲地区的疫情发展同样不容乐观。据世界卫生组织公布的最新数据,截止3月11日欧洲中部时间10点,意大利累计确诊达到10149例,而法国、西班牙以及德国的累计确诊病例也都超过了1000例。
“中国的医疗器械包括体外诊断产品过去都是由欧、美、日等发达国家引领。但由于这次新冠疫情首先在中国爆发,所以我们在试剂及配套产品的研发上先行一步,加上疫情在海外的蔓延,我觉得这正是个走出国门的机会。”一家体外诊断企业的董事长告诉《科创板日报》记者,该企业的新冠检测产品刚刚宣布获得欧盟准入资格。
“有了先发优势之后,如果产品的品质和质量也有加强,那么就非常有利于提升其他市场对中国品牌的认知度。”对方补充道。
不过,对于企业的这种想法,也有不少人表示怀疑。
“那也要看欧、美等国给不给机会了。目前来看,欧盟对中国的产品能否通过CE认证并不关心,他们在研发自己的检测产品。”有业内人士说。媒体报道显示,为应对疫情,欧盟已通过欧洲急性传染病应急平台协调了超过3000家医院和900个实验室,加强对新冠肺炎的临床研究工作。
而另一位曾就职于美国梅奥诊所的不愿意具名的业内人士同样谨慎乐观。
“国内IVD产品的精准度通常会写90%~95%,而实际上国际大厂罗X产品的精准度可能也才标85%,这个spec(Specification,产品规格说明)对罗X来说已经是最低精准度。而我们国内企业虽然精准度标了90%~95%,可实际上可能就只能达到50%~60%的精准度,所以国外对于我们中国企业标示的spec可能存在很大的疑虑。”他说。
“以国内华X基因为例,公司在检测领域已经是国内领先的龙头之一,但他们标示的spec跟国外以及产品的实际值也仍有较大差距。在这种情况下,加上现在德国、美国也有不少自己的机构在做检测产品的研发,所以要让他们来选择中国的产品预计会比较困难。”对方补充道。
不过,“东方不亮西方亮”,德、美、日等高端市场虽然难以打入,但也不是没有其他机会。早在2月底,科创板上市的东方生物便透露称,公司新型冠状病毒诊断系列产品已经完成CE合格认证程序,获得欧盟市场准入,并且已与奥地利、罗马尼亚、意大利、希腊等欧盟国家的客户签订了价值约3.5万美元的应急销售订单。
10日晚间,前述新冠检测产品已获欧盟准入资格的企业董事长亦对《科创板日报》记者表示,自产品通过欧盟CE认证后,公司已接到不少询单电话,但其未能透露这些电话的来源。
自我宣告,或是敲开欧盟大门的第一块砖
在欧盟市场,“CE”标志属于强制性认证标志,所有医疗器械投放欧盟成员国市场时须通过CE认证。这也是国际通行的做法,比如中国有CCC认证,日本有PSE认证,澳大利亚有SAA认证,其目的都是为了保障本国国民人身财产安全而推出的强制性产品认证制度。
而在企业对自家产品终获欧盟上市资格正激动不已的时候,一些人也对这些产品获得欧盟准入的手法发出了质疑,认为企业所称的“通过欧盟CE认证只是一种自我声明和宣告”,因此证书的效力并不高。
而此前,当东方生物率先公布相关消息的时候,也有业内人士对《科创板日报》记者表示,新冠病毒诊断试剂盒是一个全新的产品,但欧盟目前并没有把它列入高风险体外诊断试剂类别中,也就是默认其是一款低风险的器械。而在相关法规未来得及做出调整前,中国新冠病毒诊断系列产品按监管级别最低类产品履行并通过CE合格认证程序,“那是打擦边球行为”。
按照东方生物当时的说法,公司新冠病毒诊断系列产品属于按“其他(Other)”类别(监管级别最低)履行CE合格认证程序的医疗器械。
因此,根据《体外诊断医疗器械指令》《医疗器械法规(The Act on Medical Devices)》等规定,公司达到作出该类产品的EC合格声明的要求(具体为:完成合格的技术文件编写、具有合格的质量体系、建立质量保证程序以保证在存在产品质量问题时主动通知主管当局甚至追回产品),由德国的欧盟代表通知德国主管当局并提交相应证明文件和EC合格声明后,即完成CE合格认证程序,获得欧盟市场准入。(详情可见:关注|擦边球行为?东方生物新冠病毒诊断产品获海外订单,这二大焦点问题仍待明了)
不过,对于前述质疑,另一家新冠产品已在国内获批上市,同时也完成了欧盟CE认证的企业回复《科创板日报》记者称,将新冠试剂盒分至“others”一类并非取决于企业自己,“CE对产品分类是有定义的,others的分类是通过排除法得出的,即属于A类和B类以外的产品,就是others的产品。”对方表示。
来自某专业咨询机构的一位业内专家向《科创板日报》记者确认了以上说法。他对《科创板日报》记者表示,目前体外诊断产品进行欧盟CE认证可以依据两个指令,其一是IVDD,其二是IVDR欧盟体外诊断医疗器械法规(EU 2017/746),并且这两个都是现行法规。
其中,IVDR由欧盟于2017年5月5日正式颁布,并从2022年5月26日起生效,过渡期为5年,过渡期后所有IVD产品必须逐步满足IVDR要求(有2年宽容期)。该法规按照风险等级将IVD产品分为4类,包括:Class A(风险最低)、Class B、Class C和Class D(风险最高)。
而与IVDD相比,IVDR分类规则更加详细,分类品种也更加完善。同一款产品在IVDD和IVDR的分类条件下,其分类结果可能会完全不一样。同时,根据分类结果,厂商选择的进一步途径也可能存在着极大差异(一方是自我声明即可,另一方则需要走符合性评价途径)。
“那如果是按照现行的IVDD法规分类的话,新冠病毒检测产品按照预期用途可以属于others一类,属于最低风险。并且如果被列入others,那就可以做自我宣告,这是被法律所允许的。”他说。
“当然,如果要按照IVDR法规来走也可以,但不合理。首先,这个过程会相当复杂,花的时间也会比较长,可能认证还没做完疫情就结束了,所以走这条路会影响产品在欧盟的上市时间。其次,欧盟要在两年后才会完全切换至IVDR法规,IVDD明明两年后才会过期,那现在为什么非要换法规标准呢?”对方补充道。
奥咨达医疗器械服务集团东区CDMO总经理詹金城同样对《科创板日报》记者表示,从目前的情况来看,中国新冠病毒检测试剂产品若想要快速通过欧盟CE认证,“就只能走自我宣告这一条路”。
“如果按照IVDR法规来做CE认证的话,目前最大的问题是迄今获得IVDR资质授权的公告机构只有BSI荷兰、BSI英国和德国德凯DEKRA3家,并且这些机构现在的排单均较满,基本没有余力接其他单,中国企业想做认证的话还要排队,预计这个时间起码得一年以上。相较而言,自我宣告只需1个月就可以了。”对方说。
不过,其同时也认为,由于通过自我宣告获得欧盟CE认证的产品类似于国内一类体外诊断试剂产品(产品风险等级最低),因此美国以及欧盟一些国家可能并不会买单,而这恰恰也应证了此前一些业内人士对中国新冠病毒检测产品海外上市前景的忧虑。
虽然自我声明的others试剂并不那么广受认可,那么,又是否会有企业未雨绸缪,在先通过自我宣告这样一种快速便捷的方法获得欧盟市场准入后,同时也不打算放弃另一种可能呢?对此,奥咨达詹金城的回答是肯定的,他表示,一些大型企业考虑到长期的商业可能,会选择按IVDD法规和IVDR法规同时对相关产品进行CE认证。“但更多还是口罩、防护服企业。”他告诉记者。
除了欧盟以外,中国新冠防疫产品能否获准进入美国市场也是市场关注焦点之一。日前,曾有美国媒体报道称,受疫情影响,美国政府已经批准豁免自中国进口的100多种医疗产品的进口关税,包括口罩、手套和消毒湿巾等。
对此,詹金城表示,目前美国FDA未批准任何新冠诊断试剂上市。如果中国的新冠体外诊断产品想进入美国市场,可以先进行EUA (Emergency Use Authorization,紧急使用授权)申请,有意向申请的企业可以与FDA联系,FDA会协助企业一起完成产品的检测和验证工作。但EUA只是临时的上市“通行证”,在FDA宣布疫情结束后,获得EUA资质的产品不可再上市使用,需进行常规注册申请。
而对于口罩及防护服的出口问题,另一位业内人士则告诉《科创板日报》记者,目前美国FDA重新制定了对应条款,口罩及防护服都属于二类医疗器械,因此中国企业若想出口美国需走二类医疗器械的注册。

“掌”握科技鲜闻 (微信搜索techsina或扫描左侧二维码关注)

















